
AG Photobiophysik
Wechselwirkung von Licht mit biologischen und biomimetischen Systemen
Kontakt
Leitung: Prof. Dr. Beate Röder
Humboldt-Universität zu Berlin
Institut für Physik
AG Photobiophysik
Newtonstraße 15
12489 Berlin
Tel.: 030 - 2093 82079
Fax: 030 - 2093 7666
Photodynamische Inaktivierung Biofilmbildender Mikroorganismen - Eine Alternative zu Bioziden und Antibiotika?
 Pohl, Preuß, Röder, Photodynamic inactivation of microorganisms in "Singlet Oxygen: Applications in
Biosciences and Nanosciences" Nonell, Flors (Hrsg.), RSC Publishing, 2016
Pohl, Preuß, Röder, Photodynamic inactivation of microorganisms in "Singlet Oxygen: Applications in
Biosciences and Nanosciences" Nonell, Flors (Hrsg.), RSC Publishing, 2016
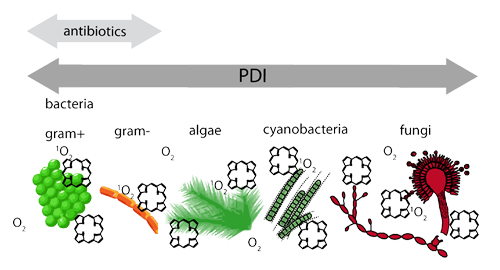
Der konventionelle Einsatz von Antibiotika und Bioziden birgt aufgrund toxischer Nebenwirkungen und einer zunehmenden Zahl resistenter Mikroorganismen diverse Risiken für Mensch und Umwelt. Verschiedene Mikroorganismen bilden Biofilme auf Oberflächen, was sie besonders widerstandsfähig gegen Umwelteinflüsse macht. Deshalb ist ein langfristiges Ziel unserer Forschung, Oberflächenmaterialien zu entwickeln welche die Entstehung von Biofilmen verhindern. Unser Hauptinteresse richtet sich dabei auf die Nutzung des seit Anfang des 20. Jahrhunderts bekannten Photodynamische Effekt.
Dieser wird bereits in verschiedenen Gebieten der Medizin, wie Onkologie, Ophthalmologie und Dermatologie im Rahmen der Photodynamischen Therapie klinisch genutzt. Die dabei verwendeten Wirkstoffe heißen Photosensibilisatoren (PS). Nach Absorption von Licht können sie über Stoßwechselwirkungen Singulettsauerstoff (1O2) zu generieren. 1O2 ist chemisch hochreaktiv und wirkt daher - direkt durch Reaktion mit überlebenswichtigen Biomolekülen, oder indirekt, durch Erzeugung anderer reaktiver Sauerstoffspezies (ROS) - zytotoxisch. Der PS geht nach der Reaktion wieder in seinen Grundzustand zurück und kann erneut 1O2 generieren, solange Licht und molekularer Sauerstoff zur Verfügung stehen und die PS-Moleküle nicht durch oxidative Prozesse zerstört werden („Bleaching“). Da PS allein nicht toxisch sind, stellen sie im Vergleich zu Bioziden und Antibiotika ein sehr viel geringes Risiko für Mensch und Umwelt dar. Die Photodynamische Inaktivierung (PDI) ist die Anwendung des Photodynamischen Effekts zur Bekämpfung von Mikroorganismen. Im Mikrobiologielabor der Arbeitsgruppe Photobiophysik werden Bakterien, Schimmelpilzen, Cyanobakterien und Grünalgen untersucht.
Anhand von multiresistentem Escherichia coli konnte gezeigt werden, dass die PDI erfolgreich gegen gram+ Bakterien wirkt, ohne dass eine intrazelluläre Aufnahme der Photosensibilisatoren nötig ist. die Wirkung der PS in unmittelbarer Nähe der Zellwände reicht aus um die Bakterien zu inaktivieren.
Besonders interessant ist die Anwendung der PDI gegen phototrophe Mikroorganismen (Pohl et al. 2015). Cyanobakterien und Grünalgen spielen eine wichtige Rolle als Primärbesiedler terrestrischer Oberflächen und damit als Initialkeime der Biofilmbildung. (Preuß et al. 2013). Auch Schimmelpilze sind Bestandteil von terrestrischen Biofilmen. Sie bilden hoch resistente Sporen aus welche kaum durch fungizide zerstört werden können und für ihre Verbreitung über den Luftstrom sorgen. Auch Schimmelpilze und deren Sporen können mittels PDI bekämpft werden (Preuß et al. 2014).
Biofilme auf Baumaterialien und Kulturgütern verursachen neben ästhetischen Problemen, Schäden an der Bausubstanz, deshalb sind besonders hier viele toxische Biozide im Einsatz. Aktuell wird in der AG Photobiophyik an Methoden gearbeitet mithilfe von Mikroorganismen, welche aus nativen Außenwand-Biofilmen entnommen wurden, reproduzierbar sowohl unter Laborbedingungen, als auch im Freiland Modellbiofilme zu züchten. Mit diesen Modellbiofilmen soll das Potential der PDI zur Verhinderung des Biofilmwachstums auf photodynamisch aktiven Oberflächen untersucht werden.
Pohl, J.; Saltsman, I.; Mahammed, A.; Gross, Z.; Röder, B. (2015): Inhibition of green algae growth by corrole-based photosensitizers. In: Journal of applied microbiology 118 (2), S. 305–312. DOI: 10.1111/jam.12690.
Preuß, A.; Saltsman, I.; Mahammed, A.; Pfitzner, M.; Goldberg, I.; Gross, Z.; Röder, B. (2014): Photodynamic inactivation of mold fungi spores by newly developed charged corroles. In: Journal of photochemistry and photobiology. B, Biology 133, S. 39–46. DOI: 10.1016/j.jphotobiol.2014.02.013.
Preuß, A.; Zeugner, L.; Hackbarth, S.; Faustino, M. A. F.; Neves, M G P M S; Cavaleiro, J. A. S.; Roeder, B. (2013): Photoinactivation of Escherichia coli (SURE2) without intracellular uptake of the photosensitizer. In: Journal of applied microbiology 114 (1), S. 36–43. DOI: 10.1111/jam.12018.
![[Siegel der Humboldt-Universität zu Berlin]](/images/husiegel.svg)

